Die Geschichte von TKTL1
Ein evolutionäres Schlüsselgen eröffnet neue Wege in Forschung und Diagnostik
TKTL1 – kurz für Transketolase-like 1 – ist ein Gen, das 1995 von Dr. Johannes Coy entdeckt wurde. Lange Zeit fand es in der Wissenschaft wenig Beachtung.
Heute jedoch rückt TKTL1 zunehmend in den Fokus, da es als entscheidender Faktor in der Evolutionsbiologie, in zellulären Prozessen sowie in der medizinischen Forschung erkannt wird. Mittlerweile weiß man: TKTL1 steuert den Zellzyklus, trug zur kognitiven Weiterentwicklung des Homo sapiens gegenüber dem Neandertaler bei und spielt eine zentrale Rolle bei der unkontrollierten Zellvermehrung in Tumoren.
Ein evolutionäres Schlüsselgen mit ungeahntem Potenzial
Mit der Verleihung des Medizin-Nobelpreises 2022 an den schwedischen Arzt und Biologen Svante Pääbo rückte TKTL1 stärker ins öffentliche und wissenschaftliche Interesse. Durch die Entschlüsselung des Neandertaler-Genoms identifizierte Pääbo eine entscheidende Mutation im TKTL1-Gen, die den modernen Menschen vom Neandertaler unterscheidet. Diese Veränderung war maßgeblich für die Gehirnentwicklung und damit für die Entstehung jener kognitiven Fähigkeiten, die den Homo sapiens einzigartig machen.
Mit dem Fortschritt der Forschung entwickelt sich TKTL1 zu einem Schlüsselthema, nicht nur für das Verständnis der menschlichen Evolution, sondern auch für neue diagnostische und therapeutische Ansätze. Die wissenschaftliche Bedeutung dieses Gens wird daher auch in Zukunft weiterwachsen.
Zwei Seiten derselben Medaille
TKTL1 übernimmt im Körper eine doppelte Funktion: Es schützt sowohl gesunde als auch degenerierte Zellen. Das Gen sorgt dafür, dass empfindliche Zellprozesse reibungslos ablaufen. So verhindert es beispielsweise Schäden an der Netzhaut durch übermäßige freie Radikale, schützt Spermien im Hoden vor DNA-Mutationen und sichert eine fehlerfreie Zellteilung.
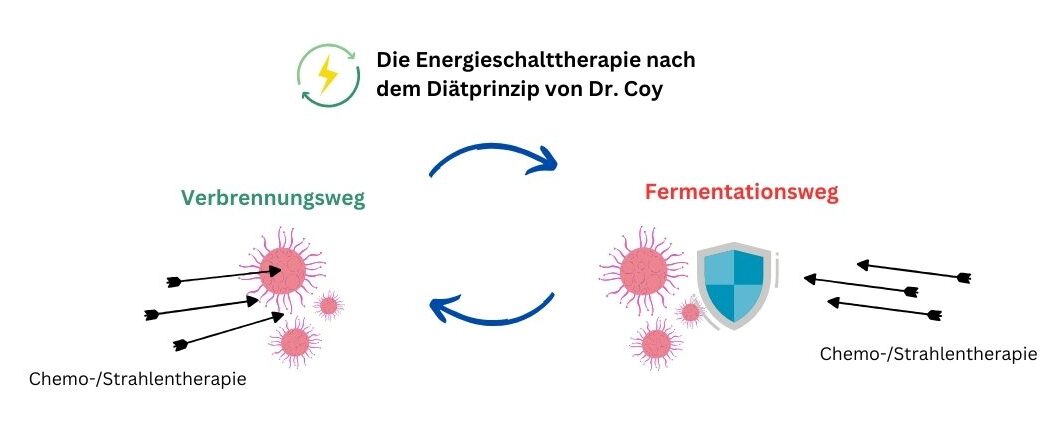
Dieser Schutzmechanismus beruht auf der Fähigkeit von TKTL1, zwischen dem aeroben, mitochondrialen Energiestoffwechsel – der zwar Energie liefert, aber schädliche Radikale erzeugt – und der anaeroben Fermentation zu wechseln. Letztere verursacht keine Radikalbildung und ist daher in sensiblen Phasen, wie der Zellteilung, von Vorteil. Auch wenn Fermentation weniger Energie liefert, überwiegt in solchen Momenten der Schutzfaktor.
Krebszellen jedoch nutzen genau diesen Mechanismus zu ihrem Vorteil: Sie schalten gezielt auf den fermentativen Stoffwechsel um, um Wachstum und Überleben zu sichern. Daraus ergeben sich mehrere für bösartige Tumorerkrankungen charakteristische Vorteile:
Beschleunigtes Wachstum:
TKTL1 unterstützt die Bildung wichtiger Bausteine wie Nukleotide.
Flucht vor dem Immunsystem:
Das bei der Fermentation entstehende Laktat bildet eine Barriere, die Immunzellen schwächt.
Gewebeinvasion und Metastasen:
Laktat schädigt das umliegende Gewebe und ermöglicht dem Tumor, sich auszubreiten.
Sicherung der Blutversorgung:
TKTL1 stabilisiert HIF-1α, einen Faktor, der das Wachstum neuer Blutgefäße anregt und damit die Nährstoffversorgung des Tumors sicherstellt.
Verhinderung des programmierten Zelltods:
TKTL1 senkt die Menge an Cytochrom c, einem zentralen Molekül der Apoptose, wodurch Krebszellen länger überleben.
Eine einfache Einführung in den TKTL1-Fermentationsweg
Neue Erkenntnisse zum Warburg-Effekt
Die Forschung von Dr. Johannes Coy hat zu einer neuen Interpretation des sogenannten „Warburg-Effekts“ geführt, der erstmals 1923/1924 von Otto Warburg beschrieben wurde. Coy fand heraus, dass die Umwandlung von Zucker zu Milchsäure – also der anaerobe Stoffwechselweg – nicht ausschließlich in Krebszellen stattfindet, selbst wenn Sauerstoff vorhanden ist. Dieser Stoffwechselweg erfüllt auch in gesunden Zellen eine wichtige Schutzfunktion.
So schützt er beispielsweise Netzhautzellen, die starker Sonneneinstrahlung ausgesetzt sind, und bewahrt Spermien im Hoden vor DNA-Mutationen. Zudem schalten alle Zellen während der empfindlichen Phase der Zellteilung vorübergehend auf den Fermentationsstoffwechsel um, ein Prozess, der durch die Aktivität des TKTL1-Gens ermöglicht wird.
Als Dr. Coy das diagnostische Potenzial von TKTL1 erkannte, begann er 2007 mit der Entwicklung eines darauf basierenden Bluttests. Das Ergebnis seiner Forschungsarbeit ist der PanTum Detect®-Bluttest, der heute weltweit kommerziell erhältlich ist und zur frühen Erkennung von Krebs eingesetzt wird.
